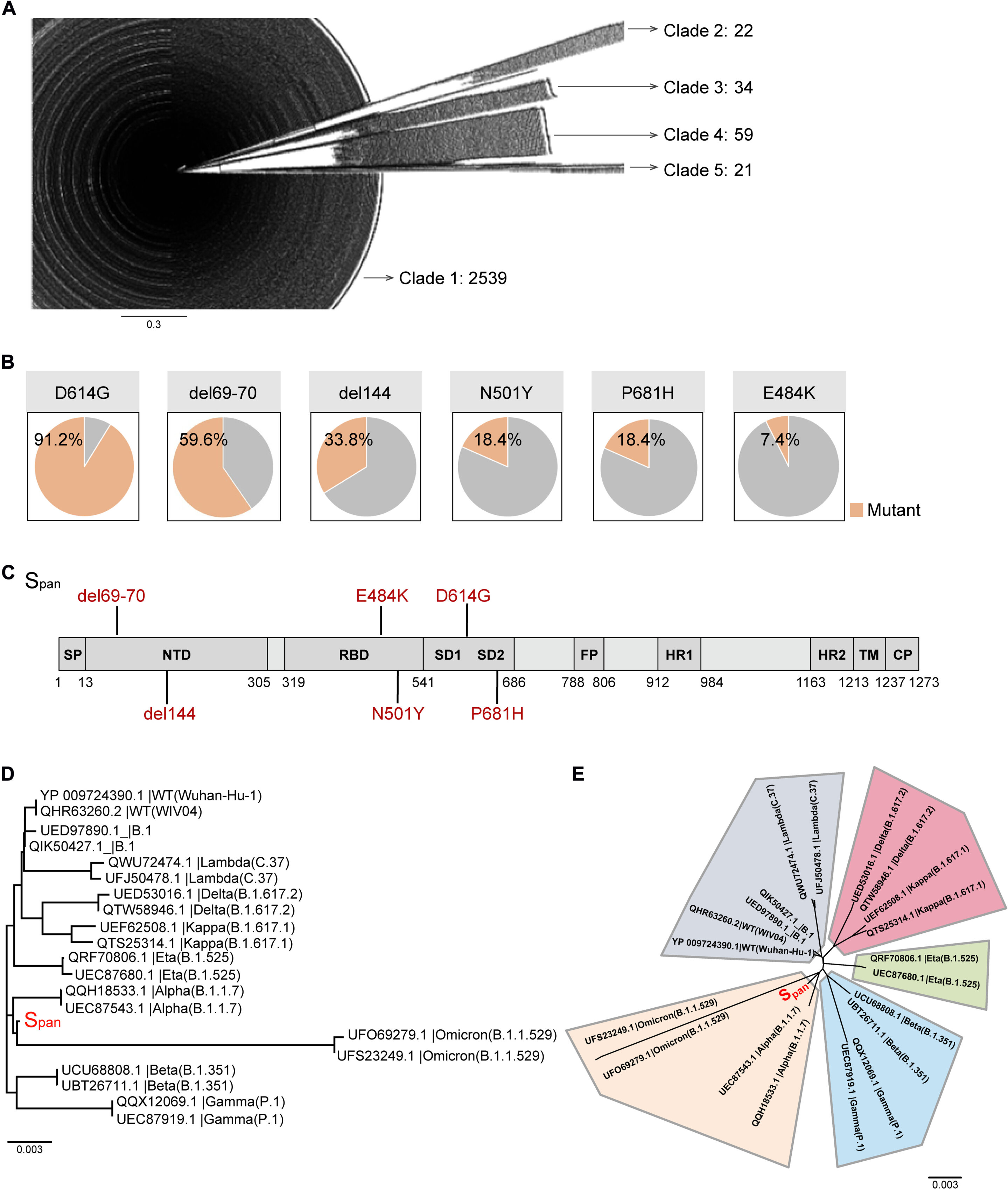
SARS-CoV-2 S蛋白进化被用于指导Span序列的设计。(A) NCBI数据库显示了2675个S蛋白氨基酸序列的系统发育树。(B) 分析的氨基酸序列中前五位突变和E484K突变的比例。(C) 全长SARS-CoV-2 S蛋白的线性图,Span突变为红色。(D和E)使用MEGA 10.0的邻居连接方法构建系统发育树,并以矩形(D)或放射状(E)显示。Span抗原以红色突出显示(Span线被放大10倍以显示)。版权:科学转化医学(2023)。DOI:10.1126/scitranslmed.abo3332
(神秘的地球uux.cn)据Delthia Ricks , Medical Xpress:中国科学家从SARS-CoV-2本身的进化史中汲取灵感,研制出了一种新疫苗,至少在动物模型中,该疫苗可以提供对抗奥密克戎及其一系列亚变体的保护。
尽管早期的SARS-CoV-2疫苗和加强剂非常成功,但病毒进化和免疫逃避的出现使得后续疫苗更难生产。疫苗学家一直在问:我们如何跟上快速发展的病原体?新冠病毒似乎总是领先几步,尤其是现在,奥密克戎亚变异株继续进化出更强的免疫逃逸能力。
科学家表示,尽管mRNA疫苗在过去两年中已成为非常宝贵的工具,但仍需要更多的疫苗方法。
事实证明,病毒刺突蛋白的区域在最近的SARS-CoV-2变体中保持高度保守。这些保守区域是真正的进化数据目录,可以用来制造下一代疫苗。刺突蛋白是与人类ACE-2受体结合以引发感染的病毒的商业端。
为了解决免疫逃逸这一关键问题,并开始研发新疫苗的艰巨任务,赵永亮博士和中国武汉大学病毒学国家重点实验室的同事们希望用一种新型疫苗来减弱亚变异株在未来的影响。
他们已经在实验室小鼠中测试的实验疫苗是基于刺突蛋白的保守区域,这意味着疫苗与很少突变的刺突部分紧密相连。
武汉团队正在悄悄地对他们的研究表示乐观,他们希望这项研究将成为未来疫苗的典范,一种泛保护性免疫――一种预防现有变异和未来可能出现的威胁的通用疫苗。当前疫苗的一个关键问题是,虽然它们可以预防严重疾病,但新版本的病毒,如奥密克龙(omicron)不断增加的亚变体,可能会越过免疫系统的防御。
赵和来自武汉多家研究机构的一组合作者通过询问SARS-CoV-2的进化轨迹,开始研发新疫苗。作为研究的关键部分,他们分析了1100多万个SARS-CoV-2序列,以及54个SARS-CoV-2假病毒和变种的传染性和免疫逃逸能力。
实验表明,病毒刺突蛋白并非随机进化,而是朝着高传染性与低免疫逃逸或低传染性与高免疫逃逸相结合的方向进化。
基于此,该团队设计了一种以名为Span的新工程抗原为中心的疫苗。名称中的字母“S”代表“spike”,如病毒刺突蛋白,“pan”来自希腊语,意为“all”,指的是针对所有刺突蛋白的疫苗。从另一个角度来看泛,将其与希腊语单词demos的一个版本结合起来,后者意味着人,你会患上“大流行”,这是一种影响所有人的疾病。
赵和他的同事在《科学转化医学》杂志上写道,研发试验性Span疫苗并不容易。“SARS-CoV-2继续积累突变以逃避免疫,导致接种疫苗后出现突破性感染,”Span疫苗研究的主要作者赵先生断言。
“研究人员如何在设计下一代疫苗时提前预测病毒的进化轨迹,需要进行调查,”赵继续说道。“在这里,我们对11650487个SARS-CoV-2序列进行了全面研究,这表明SARS-CoV 2刺突蛋白不是随机进化的,而是进化成高传染性+低免疫抗性或低传染性+高免疫抗性的定向路径。”
Span抗原结合了迄今为止在所有主要变体中以高频率发现的氨基酸残基,使其能够抵抗进化上不同的谱系。到目前为止,当在实验室中给动物模型接种疫苗时,Span疫苗已经产生了针对各种SARS-CoV-2变体的中和抗体。
赵和合作者测试了创新的斯潘疫苗,同时测试了一种由野生型刺突蛋白制成的疫苗,这种蛋白缺乏斯潘的进化嫁妆。研究人员发现,接种Span疫苗后,免疫反应比接种野生型刺突蛋白疫苗更有效。在本例的动物模型中,当注射Span疫苗时,小鼠完全免受奥密克戎变体的影响。
根据赵的说法,武汉团队需要对疫苗的有效性进行额外测试,以对抗最近出现的奥密克戎亚变体,特别是最近几个月出现的亚变体。研究人员还警告说,接种Span疫苗需要在动物模型(而不是实验室小鼠)中进行更多的测试,以更好地了解疫苗的优点和缺点。赵总结道:“在将这种疫苗转化为(人类)临床试验之前,有必要加入更多的动物模型。”。
暂无评论...